
Fragmento de Another Place (ferro colat) de Antony Gormley (1997)
Disponible en: https://www.theculturium.com/antony-gormley-sculpted-space-within-and-without/ [Consulta del 1/05/2019].
Descripción
Los metales conforman la mayor parte de la tabla periódica de los elementos, es decir, son los materiales conocidos más abundantes. Se caracterizan principalmente por ser buenos conductores del calor y de la electricidad y tener una gran densidad. Son sólidos a temperatura ambiente (exceptuando el mercurio) y en general no son reactivos entre sí, es decir, se pueden aliar o mezclar, tanto entre ellos como con otros elementos no metálicos.
De hecho, hay pocos metales que se encuentren en la naturaleza en lo que se denomina elemento nativo, es decir, como elemento no compuesto. El oro, la plata, el cobre o el mercurio serían algunos ejemplos de elementos nativos, mientras que lo más habitual es encontrar los metales en óxidos (combinados con oxígeno), en sulfuros (combinados con azufre), en cloruros, carbonatos, fosfatos, etc. Es decir, como elementos compuestos que se extraen a partir de la minería y se transforman metalúrgicamente para obtener los metales. Sin embargo, los metales que primero se utilizaron en la historia son justo los que se encuentran en estado puro, no combinados con otros materiales, como el oro, la plata o el cobre.
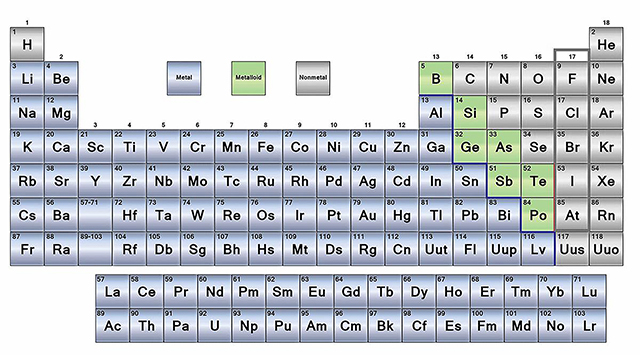
Tabla periódica de los elementos donde se indican en azul los metales, en verde los metaloides y en lila los no metales
Disponible en: https://www.thoughtco.com/metals-nonmetals-and-metalloids-periodic-table-608867 [Consulta de l’1/05/2019].
Propiedades
Maleabilidad y ductilidad
Es la capacidad de los metales para transformarse en láminas y para modelarse en hilos al ser sometidos a fuerzas de compresión y de tracción.
Elasticidad
Capacidad de los metales de recuperar la forma después de estar sometidos a una determinada presión (como pasa con los muelles o con la aleación de titanio y níquel, llamada nitinol).
Tenacidad
Es la resistencia mecánica a la ruptura por tensión, presiones y golpes. Por el contrario, los metales también pueden ser frágiles y romperse por la acción de un choque, golpe o cambio brusco de temperatura.
Forjabilidad
Posibilidad de modificación de su forma, sea en frío o mediante el aumento de temperatura y ejerciendo fuerzas de compresión, por presión o por impacto.
Soldabilidad
Propiedad de algunos metales de unir dos piezas del mismo metal formando un solo cuerpo.
Oxidación
Reacción química con el oxígeno. La oxidación se puede reducir con protecciones (barnices) o aumentar con el uso de diferentes productos.
Tipologías
Desde un punto de vista de aplicación práctica, los metales se suelen clasificar en metales ferrosos y no ferrosos.
Metales ferrosos
Son aquellos en los que el componente principal es el hierro. El hierro en estado puro se utiliza poco. Se suele encontrar en componentes electrónicos y transformadores, así como en máquinas eléctricas. Si el porcentaje de carbono es inferior al 2,1% se le denomina acero. La industria hace aleaciones con cromo y níquel para obtener aceros inoxidables, y con zinc para obtener acero galvanizado.
Metales no ferrosos
El cobre, latón, bronce, plomo, estanque, zinc, cromo, níquel, aluminio, titanio, manganeso… son metales no ferrosos que tienen numerosas aplicaciones en función de las características de cada metal, desde cableado (cobre) hasta la pirotecnia (manganeso) o la industria aeroespacial (titanio).
Seguidamente se presenta una selección de los metales más utilizados en procesos artísticos y que han tenido un uso tradicional en la historia del diseño, la escultura y la joyería principalmente.
Aluminio
En estado natural se encuentra en muchos silicatos (uno de los grupos minerales más abundante) como la bauxita, de la que se realiza su extracción. O en la caolinita, mineral básico de las arcillas. Es un metal resistente, ligero y con un punto de fusión de 660º. Pulido llega a tener una brillantez similar a la de la plata, a pesar de que se oxida con facilidad y se tiene que barnizar.
Plomo
Es un metal que se suele encontrar en estado natural como sulfuro, por ejemplo en el mineral galena, que se compone básicamente de sulfuro de plomo. Es un metal con un punto de fusión bajo (327º) y que se puede disolver con el calor de una olla. Poco resistente y propenso al deterioro en piezas grandes, es interesante para realizar coladas de pequeño formato.
Hierro
Es el cuarto elemento más abundante de la corteza terrestre y ha sido muy utilizado desde la antigüedad en fundición. En la naturaleza se encuentra formando parte de muchos óxidos y raramente se encuentra libre. Para obtener hierro los óxidos se reducen con carbono. Cuando el hierro tiene entre un 0,008 y 2,1% máximo de carbono se le denomina acero, y la ingeniería metalúrgica lo combina con otros metales para hacer aleaciones con finalidades y propiedades muy diversas. Cuando tiene más de un 2,1% de carbono, se presenta en forma de grafito. Es lo que se conoce como hierro fundido, o de fundición gris por el aspecto que tiene al romperse. Ha sido muy utilizado en todo tipo de construcciones arquitectónicas y también en escultura.
Bronce
El bronce es una aleación de cobre y estaño, con punto de fusión entre los 830º y los 1020°, muy usado en escultura tanto por su color natural como por la gama de pátinas que se le pueden aplicar.
Oro y plata
Estos metales son principalmente utilizados en joyería por su elevado coste.
Uso
En la industria y comercialmente, podemos encontrar tanto aceros como metales no ferrosos en muy diversas formas. De manera genérica los podemos clasificar en:
- Perfiles: todo tipo de barras con formas especiales. Planas o «pletinas», escuadras, en U, tubos, triangulares, vigas en T o doble T…
- Barras: de sección cuadrada o circular que, cuando son de poco diámetro, se denominan alambres.
- Lingotes: bloques de metales que se obtienen vaciando el metal en un molde.
- Chapas: obtenidas industrialmente por estampación o por laminado. Se comercializan de metales muy variados y también con formas onduladas, rugosas… para varias aplicaciones y montajes.
Los metales tienen un punto de fusión elevado, pero con hornos específicos y teniendo en cuenta las características de cada metal, se han utilizado desde la antigüedad para hacer esculturas a partir de moldes y mediante la técnica de la cera perdida (ver ficha de vaciado).
Con lo que encontramos en la industria (perfiles, barras, lingotes, chapas) se pueden realizar todo tipo de estructuras mediante la soldadura, el ensamblaje o la forja. Con las planchas de metal podemos utilizar técnicas como el repujado o realizar todo tipo de efectos sobre la superficie con las pátinas y/o el grabado con ácido. Cada proceso, cada técnica, tiene unos resultados y unas propiedades o cualidades características. Adentrarse lentamente en las diferentes técnicas nos permitirá ir conociendo los materiales y determinando sus usos en función del proyecto a desarrollar.
Para saber más
Catálogo de aleaciones para escultura y joyería: https://www.belmontmetals.com/es/categoria-producto/aleaciones-para-escultura/
Catálogo de esculturas de metal: http://www.archiexpo.es/fabricante-arquitectura-design/escultura-metal-42100.html
Codina, C. (2003) La Joyería. Barcelona: Parramón.
Hiscox, G. D.; Hopkins, A. A. (2016). El Recetario Industrial (1ª ed. 1934). Barcelona: Gustavo Gili. https://vdocuments.mx/el-recetario-industrial-hiscox-hopkins.html
Varios autores (2008). Los metales en Castilla y León. Boecillo (Valladolid): Sociedad de investigación y explotación minera de Castilla y León (SIEMCALSA).
Varios autores (1982). Guía completa de escultura, modelado y cerámica. Técnicas y materiales. Madrid: Blume.
Técnicas asociadas
Soldar
Vaciar
Ensamblar
